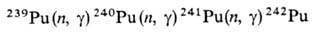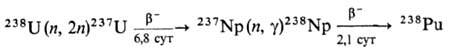|
Реклама |
|
|  |
|
|
|
|
|
ПЛУТОНИЙ
(от назв.
планеты Плутон; лат. Plutonium) Pu, искусств. радиоактивный хим. элемент III
гр. периодич. системы, ат. н. 94, ат. м. 244,0642; относится к актиноидам.
Стабильных изотопов не имеет. Известны 15 изотопов с мае. ч. 232-246. Наиб.
долгоживущие изотопы - 244Pu (T1/2 8,26·107
лет), 242Pu (T1/2 3,76 · 105 лет, поперечное
сечение захвата тепловых нейтронов s 1,9· 10- 27
м2), 239 Pu (T1/2 2,41 ·104
лет, s 2,71 · 10- 26м2) и 238Pu
(T1/2 87,74 г, s 5 ·10 -26 м2)-a-излучатели.
В природе П. встречается в ничтожных кол-вах в урановых рудах (239
Pu); он образуется из
U под действием нейтронов, источниками к-рых являются р-ции (a,n), протекающие
при взаимод. a-частиц с легкими элементами (входящими в состав руд), спонтанное
деление ядер U и космич. излучение. Конфигурация внеш. электронных оболочек
атома 5s2 5p65d10
5f 66s26p67s2;
степень окисления от + 3 до + 7, наиб. устойчива + 4; электроотрицательность
по Полингу 1,2; атомный радиус 0,160 нм, ионные радиусы Pu3+, Pu4+,
Pu5+ и Pu6+ соотв. 0,0974, 0,0896, 0,087 и 0,081 нм.
Свойства. П.-хрупкий
серебристый металл. Существует в шести кристаллич. модификациях (табл. 1); т.
пл. 6400C, т. кип. 33520C; рентгеновская плотн. 19,86
г/см3; 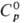 32,77 Дж/(моль · К);
32,77 Дж/(моль · К); 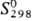 56,46 Дж / (моль · К); ур-ние температурной зависимости давления пара над жидким
П.: lg p (мм рт. ст.) = -17120/T+ 4,592 (1210-1620 К); теплопроводность
0,033 Вт/(см·К) (313 К); r 145 мкОм·см для a-Pu; парамаг-нетик, магн.
восприимчивость изменяется от 2,52· 10-6 (при 1400C, b-Pu)
до 2,35·10- 6 (4000C, d-Pu); g жидкого
П. при 6400C (0,437-0,475)· 10- 2 Н/см; ур-ние
температурной зависимости вязкости lg h = 672/T+ 0,037 (920- 1220
К); при нагр. от 3100C до 4800C сжимается.
56,46 Дж / (моль · К); ур-ние температурной зависимости давления пара над жидким
П.: lg p (мм рт. ст.) = -17120/T+ 4,592 (1210-1620 К); теплопроводность
0,033 Вт/(см·К) (313 К); r 145 мкОм·см для a-Pu; парамаг-нетик, магн.
восприимчивость изменяется от 2,52· 10-6 (при 1400C, b-Pu)
до 2,35·10- 6 (4000C, d-Pu); g жидкого
П. при 6400C (0,437-0,475)· 10- 2 Н/см; ур-ние
температурной зависимости вязкости lg h = 672/T+ 0,037 (920- 1220
К); при нагр. от 3100C до 4800C сжимается.
Компактный П. медленно
окисляется на воздухе, порошок и стружка пирофорны; медленно взаимод. с водой,
раств. в соляной к-те, HClO4, HBr и H3PO4,
пассивируется конц. HNO3, CH3COOH и H2SO4;
в р-рах щелочей заметно не растворяется. При 50-3000C П. взаимод.
с H2, давая гидрид PuH2+х (x = 0-0,7)-черные кристаллы
с кубич. гра-нецентрир. решеткой. При избытке H2 образуется три-гидрид
PuH3-черные кристаллы с гексагон. решеткой (а = 0,378 нм,
с = 0,676 нм, пространств. группа P63/mmc);
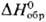 — 193,2
кДж/моль. Для дигидрида PuH2 — 193,2
кДж/моль. Для дигидрида PuH2 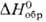 -156,7 кДж/моль (923
К); ур-ние температурной зависимости давления разложения: lgp 1(мм рт.
ст.) = 10,01 — 8156/T (400-800 К); выше 400 0C в вакууме разлагается
с образованием мелкодисперсного П.; на воздухе быстро окисляется при 150 0C;
разлагается соляной и серной к-тами; используют в качестве исходного в-ва для
синтеза др. соед. Pu.
-156,7 кДж/моль (923
К); ур-ние температурной зависимости давления разложения: lgp 1(мм рт.
ст.) = 10,01 — 8156/T (400-800 К); выше 400 0C в вакууме разлагается
с образованием мелкодисперсного П.; на воздухе быстро окисляется при 150 0C;
разлагается соляной и серной к-тами; используют в качестве исходного в-ва для
синтеза др. соед. Pu.
При прокаливании оксалата,
пероксида и др. соединений П. на воздухе или в атмосфере O2 при 700-1000
0C получают диоксид PuO2; ур-ние температурной зависимости
давления пара: lg p (мм. рт. ст.) = 8,072 - 29240/T(2000-2400
К); не раств. в воде и орг. р-рителях, медленно взаимод. с горячей смесью конц.
HNO3 с HF (см. также табл. 2); PuO2-весовая форма при
определении П., его используют также для приготовления топлива в ядерной энергетике.
Сескви-оксид Pu2O3 (т. пл. 2085 0C), синтезированный
нагреванием PuO2 и углерода в токе Не при 16250C, имеет
гексагон. кристаллич. решетку (а = 0,3841 нм, с = 0,5958 нм, пространств.
группа Р3тb); 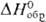 — 1688,6 кДж/моль; Pu2O3, полученный восстановлением
PuO2 металлическим П. или гидридом П. при 1500 0C, - кристаллы
с кубич. объемноцент-рир. решеткой (а = 1,104 нм, пространств. группа
Ia3, a-форма) или с кубич. гранецентрир. решеткой (а = 0,5409
нм, a-форма).
— 1688,6 кДж/моль; Pu2O3, полученный восстановлением
PuO2 металлическим П. или гидридом П. при 1500 0C, - кристаллы
с кубич. объемноцент-рир. решеткой (а = 1,104 нм, пространств. группа
Ia3, a-форма) или с кубич. гранецентрир. решеткой (а = 0,5409
нм, a-форма).
Гидраты пероксида PuO4·nH2O
(п = 2, 3) образуются при добавлении H2O2 к кислым
р-рам соединений П.; плохо раств. в воде и орг. р-рителях; при нагр. превращ.
в PuO2. Гидр оксид Pu(OH)4 · xH2O получают
при действии щелочи на r-ры Pu4 + ; произведение
р-римости 7·10-56, р-римость при 25 0C в 1 M р-ре Na2SO4
(рН 6,2) 5,9 мг/мл, в 1 M р-ре Na2CO3-1,572 мг/л, в насыщ.
р-ре KCl-6,92 · 10 -6 моль/л.
Гексафторид PuF6-T.
кип. 62,20C; 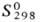 220,7 Дж/(моль·К); ур-ния температурной зависимости давления пара: над твердым
PuF6 lg p (мм рт. ст.) = — 2095/T+ 3,499 (273-324,59
К), над жидким- lg p (мм рт. ст.) = - 1807,5/T- 1,5340
(324,59 — 350,17 К); сильный фторирующий агент и окислитель; бурно реагирует
с водой; получают действием F2 на PuF4 или PuO2
при 600-7000C. Тетрафторид PuF4 -т. кип. 12770C;
С0р 116,36 Дж/(моль·К);
220,7 Дж/(моль·К); ур-ния температурной зависимости давления пара: над твердым
PuF6 lg p (мм рт. ст.) = — 2095/T+ 3,499 (273-324,59
К), над жидким- lg p (мм рт. ст.) = - 1807,5/T- 1,5340
(324,59 — 350,17 К); сильный фторирующий агент и окислитель; бурно реагирует
с водой; получают действием F2 на PuF4 или PuO2
при 600-7000C. Тетрафторид PuF4 -т. кип. 12770C;
С0р 116,36 Дж/(моль·К); 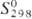 167,14 Дж/(моль·К); ур-ние температурной зависимости давления пара: lg p
(мм рт. ст.) = 5,58 - 10040/T (700-1200 К); плохо раств. в воде и орг.
р-рителях; получают нагреванием PuO2 или PuF3 в токе HF
и O2 при 450-6000C. Трифторид PuF3, трихлорид
PuCl3 (т. кип. 17670C) и трибромид PuBr3 синтезируют
взаимод. PuO2 соотв. с безводным HF (при 250-3000C), HCl
(CCl4 или SCl2 выше 7500C) и HBr (при 8000C),
трииодид PuI3-взаимод. безводного газообразного HI с металлическим
П. при 4500C.
167,14 Дж/(моль·К); ур-ние температурной зависимости давления пара: lg p
(мм рт. ст.) = 5,58 - 10040/T (700-1200 К); плохо раств. в воде и орг.
р-рителях; получают нагреванием PuO2 или PuF3 в токе HF
и O2 при 450-6000C. Трифторид PuF3, трихлорид
PuCl3 (т. кип. 17670C) и трибромид PuBr3 синтезируют
взаимод. PuO2 соотв. с безводным HF (при 250-3000C), HCl
(CCl4 или SCl2 выше 7500C) и HBr (при 8000C),
трииодид PuI3-взаимод. безводного газообразного HI с металлическим
П. при 4500C.
Табл. 1.-ХАРАКТЕРИСТИКА
КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ ПЛУТОНИЯ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Область существования,
0C
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3,43 (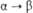 ) )
|
|
|
|
|
|
|
|
|
|
|
|
0,565 (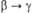 ) )
|
|
|
|
|
|
|
|
|
|
|
|
0,586 (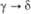 ) )
|
|
|
|
|
|
|
|
|
|
|
|
0,084 (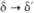 ) )
|
|
|
|
|
|
|
|
|
|
|
|
1,841 (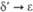 ) )
|
|
|
|
|
|
|
|
|
|
|
|
2,824 (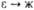 ) )
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Табл. 2.-ХАРАКТЕРИСТИКА
СОЕДИНЕНИЙ ПЛУТОНИЯ
|
|
|
|
|
|
|
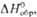
кДж/моль
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Моносульфид PuS синтезируют
восстановлением PuF3 парами Ba в тигле, изготовленном из BaS, при
12500C, действием паров S на металлический П. (стружка) при 300 0C
или нагреванием гидридов П. в токе H2S до 400-6000C. Сульфид
состава Pu2S3-Pu3S4 получен нагреванием
PuCl3 в токе H2S при 840-9160C. Известен монофосфид
PuP, к-рый образуется при взаимодействии П. с парами P при 650-8050C.
Соединения П. с кремнием-моносили-цид PuSi, сесквисилицид Pu2Si3
и дисилицид PuSi2-синтезируют взаимод. PuO2, PuF3
или металлического П. соотв. с SiC, Si и CaSi2 при высоких т-рах.
Формальные окислит. потенциалы
П. (в В) в 1 M р-ре HClO4:
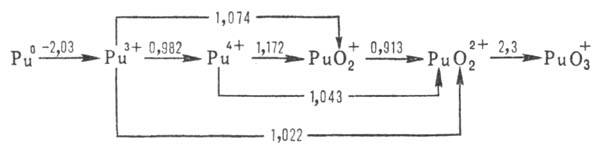
П. в степени окисления
+ 7 впервые получили в 1967 H. H. Крот и А. Д. Гельман окислением 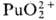 озоном в щелочной среде. В кислых водных р-рах П. существует в виде ионов Pu3+
(для водного р-ра
озоном в щелочной среде. В кислых водных р-рах П. существует в виде ионов Pu3+
(для водного р-ра  —591,2
кДж/моль, цвет в р-ре сине-фиолетовый), Pu4+ (для водного р-ра —591,2
кДж/моль, цвет в р-ре сине-фиолетовый), Pu4+ (для водного р-ра  — 541,3 кДж/моль, желто-коричневый),
— 541,3 кДж/моль, желто-коричневый),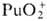 (для водного р-ра
(для водного р-ра 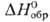 —
923,8 кДж / моль, светло-розовый), —
923,8 кДж / моль, светло-розовый), 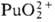 (для водного р-ра
(для водного р-ра 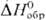 —
819,6 кДж/моль, розово-оранжевый). Ионы Pu4+ и PuO+2
в водных р-рах диспропорционируют: —
819,6 кДж/моль, розово-оранжевый). Ионы Pu4+ и PuO+2
в водных р-рах диспропорционируют:
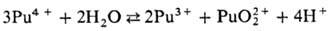
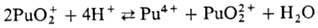
Склонность ионов П. к диспропорционированию
и комплек-сообразованию уменьшается в ряду Pu4+>Pu3+>
> 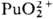 >
>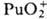 .
Pu(IV) можно получить окислением Pu(III) в кислых р-рах ионами .
Pu(IV) можно получить окислением Pu(III) в кислых р-рах ионами 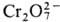 , ,
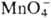 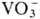
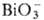 _и Ce4
+, а также при восстановлении Pu(VI) ионами Fe2+, I-
, _и Ce4
+, а также при восстановлении Pu(VI) ионами Fe2+, I-
, 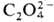 . Pu(IV)
образует полимерные цепи даже в кислых р-рах, скорость полимеризации определяется
концентрацией к-ты и П., присутствием др. ионов и т-рой. Pu(VI) можно получить
окислением Pu(III) или Pu(IV) в р-рах HNO3 ионами Ag2+, . Pu(IV)
образует полимерные цепи даже в кислых р-рах, скорость полимеризации определяется
концентрацией к-ты и П., присутствием др. ионов и т-рой. Pu(VI) можно получить
окислением Pu(III) или Pu(IV) в р-рах HNO3 ионами Ag2+,
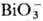 , , 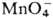 или
или 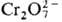 в
разб. HClO4, а также действием O3, Ce4+. в
разб. HClO4, а также действием O3, Ce4+.
Получение. Наиб.
важный в практич. отношении изотоп 239Pu получают в ядерных реакторах
при длит. облучении нейтронами прир. или обогащенного U:
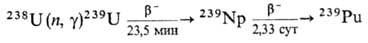
При захвате нейтронов 239Pu
образуются более тяжелые изотопы П. с мае. ч. 240-242:
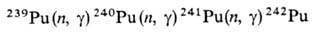
Одновременно в результате
ядерной р-ции образуется 238Pu:
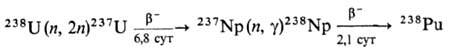
Обычно содержание 239Pu
в смеси составляет 90-95%, 240Pu-1-7%, содержание др. изотопов не
превышает десятых долей процента. Долгоживущие изотопы Pu и 244Pu
получают при длит. облучении нейтронами 239Pu. Выход 242Pu
составляет неск. десятков процентов, a 244Pu - доли процента от содержания
242Pu. Весовые кол-ва изотопно чистого 238Pu образуются
при облучении нейтронами 237Np. Легкие изотопы П. с мас. ч. 232-237
обычно получают на циклотроне при облучении изотопов U a-частицами. Выделение
и очистку изотопов П. осуществляют преим. экстракционными
и сорбционными методами. Для пром. произ-ва 239Pu используют пьюрекс-процесс,
основанный на экстракции трибутилфосфатом в легком разбавителе. В первом цикле
осуществляют совместную очистку Pu и U от продуктов деления, а затем их разделение.
Во втором и третьем циклах П. подвергают дальнейшей очистке и концентриро-ванию.
Металлический П. получают восстановлением PuF4 или PuCl3
кальцием или магнием.
Применение. Изотоп
239Pu (наряду с U) используют в качестве ядерного топлива энергетич.
реакторов, работающих на тепловых и особенно на быстрых нейтронах, а также при
изготовлении ядерного оружия. Критич. масса для 239Pu в виде металла
составляет 5,6 кг. Изотоп 239Pu является также исходным в-вом для
получения в ядерных реакторах трансплутониевых элементов. 238Pu применяют
в малогабаритных ядерных источниках электрич. тока, используемых в космич. исследованиях,
а также в стимуляторах сердечной деятельности человека.
Произ-во П. в капиталистич.
странах составляет неск. десятков т в год.
П. высокотоксичен; ПДК
для 239Pu в открытых водоемах и в воздухе рабочих помещений составляет
соотв. 81,4 и 3,3·10-5Бк/л.
Впервые П. получили и идентифицировали
в 1940 Г. Си-борг, Э. Макмиллан, Дж. Кеннеди и А. Валь.
Лит.: Плутоний.
Справочник, под ред. О. Вика, пер. с англ., M., 1971; Громов Б. В., Савельева
В. И., Шевченко В. Б., Химическая технология облученного ядерного топлива, M.,
1983; Мефодьева M. П., Крот H. H., Соединения трансурановых элементов, M., 1987;
Cleveland J. M., The chemistry of plutonium, N.Y., 1970. Б. Ф. Мясоедов.

|
|
|



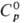 32,77 Дж/(моль · К);
32,77 Дж/(моль · К); 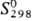 56,46 Дж / (моль · К); ур-ние температурной зависимости давления пара над жидким
П.: lg p (мм рт. ст.) = -17120/T+ 4,592 (1210-1620 К); теплопроводность
0,033 Вт/(см·К) (313 К); r 145 мкОм·см для a-Pu; парамаг-нетик, магн.
восприимчивость изменяется от 2,52· 10-6 (при 1400C, b-Pu)
до 2,35·10- 6 (4000C, d-Pu); g жидкого
П. при 6400C (0,437-0,475)· 10- 2 Н/см; ур-ние
температурной зависимости вязкости lg h = 672/T+ 0,037 (920- 1220
К); при нагр. от 3100C до 4800C сжимается.
56,46 Дж / (моль · К); ур-ние температурной зависимости давления пара над жидким
П.: lg p (мм рт. ст.) = -17120/T+ 4,592 (1210-1620 К); теплопроводность
0,033 Вт/(см·К) (313 К); r 145 мкОм·см для a-Pu; парамаг-нетик, магн.
восприимчивость изменяется от 2,52· 10-6 (при 1400C, b-Pu)
до 2,35·10- 6 (4000C, d-Pu); g жидкого
П. при 6400C (0,437-0,475)· 10- 2 Н/см; ур-ние
температурной зависимости вязкости lg h = 672/T+ 0,037 (920- 1220
К); при нагр. от 3100C до 4800C сжимается.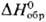 — 193,2
кДж/моль. Для дигидрида PuH2
— 193,2
кДж/моль. Для дигидрида PuH2 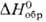 -156,7 кДж/моль (923
К); ур-ние температурной зависимости давления разложения: lgp 1(мм рт.
ст.) = 10,01 — 8156/T (400-800 К); выше 400 0C в вакууме разлагается
с образованием мелкодисперсного П.; на воздухе быстро окисляется при 150 0C;
разлагается соляной и серной к-тами; используют в качестве исходного в-ва для
синтеза др. соед. Pu.
-156,7 кДж/моль (923
К); ур-ние температурной зависимости давления разложения: lgp 1(мм рт.
ст.) = 10,01 — 8156/T (400-800 К); выше 400 0C в вакууме разлагается
с образованием мелкодисперсного П.; на воздухе быстро окисляется при 150 0C;
разлагается соляной и серной к-тами; используют в качестве исходного в-ва для
синтеза др. соед. Pu.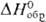 — 1688,6 кДж/моль; Pu2O3, полученный восстановлением
PuO2 металлическим П. или гидридом П. при 1500 0C, - кристаллы
с кубич. объемноцент-рир. решеткой (а = 1,104 нм, пространств. группа
Ia3, a-форма) или с кубич. гранецентрир. решеткой (а = 0,5409
нм, a-форма).
— 1688,6 кДж/моль; Pu2O3, полученный восстановлением
PuO2 металлическим П. или гидридом П. при 1500 0C, - кристаллы
с кубич. объемноцент-рир. решеткой (а = 1,104 нм, пространств. группа
Ia3, a-форма) или с кубич. гранецентрир. решеткой (а = 0,5409
нм, a-форма).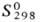 220,7 Дж/(моль·К); ур-ния температурной зависимости давления пара: над твердым
PuF6 lg p (мм рт. ст.) = — 2095/T+ 3,499 (273-324,59
К), над жидким- lg p (мм рт. ст.) = - 1807,5/T- 1,5340
(324,59 — 350,17 К); сильный фторирующий агент и окислитель; бурно реагирует
с водой; получают действием F2 на PuF4 или PuO2
при 600-7000C. Тетрафторид PuF4 -т. кип. 12770C;
С0р 116,36 Дж/(моль·К);
220,7 Дж/(моль·К); ур-ния температурной зависимости давления пара: над твердым
PuF6 lg p (мм рт. ст.) = — 2095/T+ 3,499 (273-324,59
К), над жидким- lg p (мм рт. ст.) = - 1807,5/T- 1,5340
(324,59 — 350,17 К); сильный фторирующий агент и окислитель; бурно реагирует
с водой; получают действием F2 на PuF4 или PuO2
при 600-7000C. Тетрафторид PuF4 -т. кип. 12770C;
С0р 116,36 Дж/(моль·К); 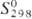 167,14 Дж/(моль·К); ур-ние температурной зависимости давления пара: lg p
(мм рт. ст.) = 5,58 - 10040/T (700-1200 К); плохо раств. в воде и орг.
р-рителях; получают нагреванием PuO2 или PuF3 в токе HF
и O2 при 450-6000C. Трифторид PuF3, трихлорид
PuCl3 (т. кип. 17670C) и трибромид PuBr3 синтезируют
взаимод. PuO2 соотв. с безводным HF (при 250-3000C), HCl
(CCl4 или SCl2 выше 7500C) и HBr (при 8000C),
трииодид PuI3-взаимод. безводного газообразного HI с металлическим
П. при 4500C.
167,14 Дж/(моль·К); ур-ние температурной зависимости давления пара: lg p
(мм рт. ст.) = 5,58 - 10040/T (700-1200 К); плохо раств. в воде и орг.
р-рителях; получают нагреванием PuO2 или PuF3 в токе HF
и O2 при 450-6000C. Трифторид PuF3, трихлорид
PuCl3 (т. кип. 17670C) и трибромид PuBr3 синтезируют
взаимод. PuO2 соотв. с безводным HF (при 250-3000C), HCl
(CCl4 или SCl2 выше 7500C) и HBr (при 8000C),
трииодид PuI3-взаимод. безводного газообразного HI с металлическим
П. при 4500C.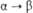 )
)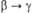 )
)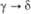 )
)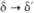 )
)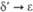 )
)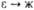 )
)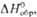

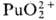 озоном в щелочной среде. В кислых водных р-рах П. существует в виде ионов Pu3+
(для водного р-ра
озоном в щелочной среде. В кислых водных р-рах П. существует в виде ионов Pu3+
(для водного р-ра 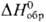 —591,2
кДж/моль, цвет в р-ре сине-фиолетовый), Pu4+ (для водного р-ра
—591,2
кДж/моль, цвет в р-ре сине-фиолетовый), Pu4+ (для водного р-ра 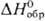 — 541,3 кДж/моль, желто-коричневый),
— 541,3 кДж/моль, желто-коричневый),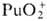 (для водного р-ра
(для водного р-ра 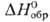 —
923,8 кДж / моль, светло-розовый),
—
923,8 кДж / моль, светло-розовый), 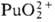 (для водного р-ра
(для водного р-ра 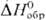 —
819,6 кДж/моль, розово-оранжевый). Ионы Pu4+ и PuO+2
в водных р-рах диспропорционируют:
—
819,6 кДж/моль, розово-оранжевый). Ионы Pu4+ и PuO+2
в водных р-рах диспропорционируют: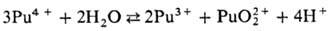
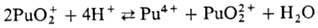
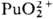 >
>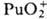 .
Pu(IV) можно получить окислением Pu(III) в кислых р-рах ионами
.
Pu(IV) можно получить окислением Pu(III) в кислых р-рах ионами 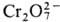 ,
,
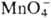
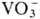
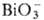 _и Ce4
+, а также при восстановлении Pu(VI) ионами Fe2+, I-
,
_и Ce4
+, а также при восстановлении Pu(VI) ионами Fe2+, I-
, 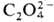 . Pu(IV)
образует полимерные цепи даже в кислых р-рах, скорость полимеризации определяется
концентрацией к-ты и П., присутствием др. ионов и т-рой. Pu(VI) можно получить
окислением Pu(III) или Pu(IV) в р-рах HNO3 ионами Ag2+,
. Pu(IV)
образует полимерные цепи даже в кислых р-рах, скорость полимеризации определяется
концентрацией к-ты и П., присутствием др. ионов и т-рой. Pu(VI) можно получить
окислением Pu(III) или Pu(IV) в р-рах HNO3 ионами Ag2+,
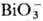 ,
, 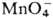 или
или 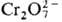 в
разб. HClO4, а также действием O3, Ce4+.
в
разб. HClO4, а также действием O3, Ce4+.